Forschungsprojekt CANACO gestartet: bessere bildgestützte und zielgerichtete Therapie von Darmkrebs mit geringen Nebenwirkungen

(umg) Etwa 60.000 Frauen und Männer erkranken jedes Jahr in Deutschland an Darmkrebs. Er ist damit die dritthäufigste Krebserkrankung in der Bundesrepublik. Die Behandlung von Darmkrebspatient*innen ist dabei eine große Herausforderung: Die Tumoren weisen große molekularbiologische Unterschiede auf und verursachen verschiedenste Symptome. Mehr als 50 Prozent der Betroffenen entwickeln Tochtergeschwulste, auch Metastasen genannt, die sich an anderer Stelle im Körper ansiedeln können. Dies führt zu einer ungünstigen Prognose auf Besserung. Die Wirksamkeit der medikamentösen Therapie bei metastasiertem Darmkrebs ist häufig eingeschränkt und kann mit schweren Nebenwirkungen einhergehen.
Um eine wirksamere Therapie für Patient*innen mit Dickdarm- oder Mastdarmkrebs (kolorektales Karzinom (CRC)) zu erreichen, wurde das Verbundprojekt „Krebs-spezifische Multidrug Nanocarrier für die Therapie und Bildgebung des kolorektalen Karzinoms“, kurz CANACO, im Rahmen des Förderschwerpunktes 'Translationale Onkologie' der Deutschen Krebshilfe initiiert. Das mit knapp einer Million Euro geförderte Forschungsvorhaben wird koordiniert durch Prof. Dr. Frauke Alves, Leiterin der Arbeitsgruppe „Translationale Molekulare Bildgebung“, die sowohl an der Klinik für Hämatologie und Medizinische Onkologie und des Instituts für Diagnostische und Interventionelle Radiologie der Universitätsmedizin Göttingen (UMG) als auch am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften (MPI-NAT) angesiedelt ist. An dem Projekt ist ein fachübergreifendes Konsortium aus Biolog*innen, Chemiker*innen sowie klinisch-orientierten Forscher*innen und Kliniker*innen beteiligt: i) vom onkologischen Spitzenzentrum der UMG: Priv.-Doz. Dr. Dr. Lena-Christin Conradi, Klinik für Allgemein-, Viszeral- und Kinderchirurgie, Leiterin der Arbeitsgruppe „Tumorzellmetabolismus und epigenetische Regulation bei der Entwicklung neuer Therapieansätze für Kolorektale und Pankreaskarzinome“, und Priv.-Doz. Dr. Joanna Napp, Translationale Molekulare Bildgebung; ii) von der Klinik und Poliklinik für Nuklearmedizin am Klinikum rechts der Isar der Technischen Universität München (TUM) als weiteres onkologisches Spitzenzentrum: Prof. Dr. Susanne Kossatz, Leiterin der Forschungsgruppe „Imaging & Biomarkers in Oncology“, und Dr. Alexander Wurzer, Wissenschaftlicher Mitarbeiter sowie iii) vom Karlsruher Institut für Technologie (KIT): Prof. Dr. Claus Feldmann, Direktor des Instituts für Anorganische Chemie.
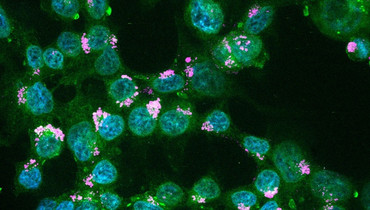
Um eine höhere Wirksamkeit der Therapie von Darmkrebs bei gleichzeitig reduziertem Nebenwirkungsprofil zu erzielen, setzen die Forscher*innen auf die Verwendung von neuartigen, vielseitig modifizierbaren Nanopartikeln mit einer Größe unter 100 Nanometer. Sie sind damit rund tausendmal kleiner als der Durchmesser eines Haares. Diese Partikel wurden von Prof. Feldmann für den spezifischen Transport von Medikamenten in die Tumorzelle maßgeschneidert und werden aufgrund ihrer Funktion auch als „Nanocarrier“ bezeichnet. Diese im Projekt verwendeten „Multidrug Targeted Nanocarrier“ (MTNC) können deutlich mehr Wirkstoff aufnehmen als herkömmliche Nanocarrier und mindestens zwei Wirkstoffe gleichzeitig transportieren. Zusätzlich besitzen die MTNC auf ihrer Oberfläche tumorspezifische Antikörper oder Peptide, kurzkettige Eiweiße, die die Bindung an die Tumorzellen begünstigen. Die Anreicherung der enthaltenen Chemotherapeutika im Tumor wird dadurch erhöht und Nebenwirkungen reduziert.
Die therapeutische Wirksamkeit der MTNC wird in klinisch relevanten Mausmodellen für Darmkrebs überprüft, in denen Tumoren aus Patient*innenmaterial wachsen. Um die Verteilung der Nanopartikel sowie die Freisetzung und Abgabe der Wirkstoffe tief im Gewebe mittels optischer Bildgebung im lebenden Organismus zu verfolgen, werden die MTNC mit Fluoreszenzfarbstoffen ausgestattet. Diese werden mit Licht angeregt, beginnen zu leuchten, und können so mit einem speziellen Kamerasystem im Mausmodell nachgewiesen werden. Auf diese Weise kann das Therapiekonzept präklinisch überprüft und optimiert werden. Zudem wird die Anreicherung der MTNC im Tumor durch ein weiteres bildgebendes Verfahren, die sogenannte Positronen-Emissions-Tomografie (PET), überprüft, eine Methode, die auch für die Anwendung am Menschen geeignet ist. Hierzu werden die MTNC mit Radionukliden markiert und ihre Verteilung anhand der abgegebenen Strahlung ermittelt, um so die Patient*innen auszuwählen, die für eine Therapie mit MTNC infrage kommen.
„Wir erwarten, dass der hohe Gehalt an klinisch zugelassenen Chemotherapeutika, die wir in unseren Multidrug Targeted Nanocarriern transportieren können, eine höhere therapeutische Wirksamkeit bei gleichzeitig verminderten Nebenwirkungen gestattet. Das Verfahren hat großes Potenzial, zukünftig in personalisierten Therapien für Darmkrebspatient*innen eingesetzt zu werden und das Gesamtüberleben zu verbessern“, sagt Prof. Alves.
Die Studien in Zellkulturen und Tiermodellen von CANACO sind strikt darauf ausgerichtet, alle notwendigen Informationen für die Durchführung einer klinischen Studie für Patient*innen zu liefern.
KONTAKT
Universitätsmedizin Göttingen, Georg-August-Universität
Klinik für Hämatologie und Medizinische Onkologie
Institut für Diagnostische und Interventionelle Radiologie
Prof. Dr. Frauke Alves, Telefon 0551 / 39-66991
Robert-Koch-Straße 40, 37075 Göttingen
frauke.alves(at)med.uni-goettingen.de
Universitätsmedizin Göttingen, Georg-August-Universität
UniversitätsKrebszentrum Göttingen (G-CCC)
Öffentlichkeitsarbeit und Wissenschaftskommunikation
Mandy Dall, Telefon 0551 / 39-62152
Von-Bar-Straße 2/4, 37075 Göttingen
ccc.news(at)med.uni-goettingen.de, gccc.umg.eu